A Agência Nacional de Vigilância Sanitária (Anvisa) liberou nesta sexta-feira (23) a importação de 6 milhões de doses da CoronaVac, vacina chinesa que deverá ser produzida pelo Instituto Butantan, em São Paulo.
A decisão não trata do pedido feito pelo governo paulista para que seja liberada a importação de insumos para produção da vacina no Brasil.
A vacina está atualmente em desenvolvimento e na terceira fase de testes. Ela é produzida pela Sinovac, farmacêutica chinesa, e ainda não foi liberada para uso.
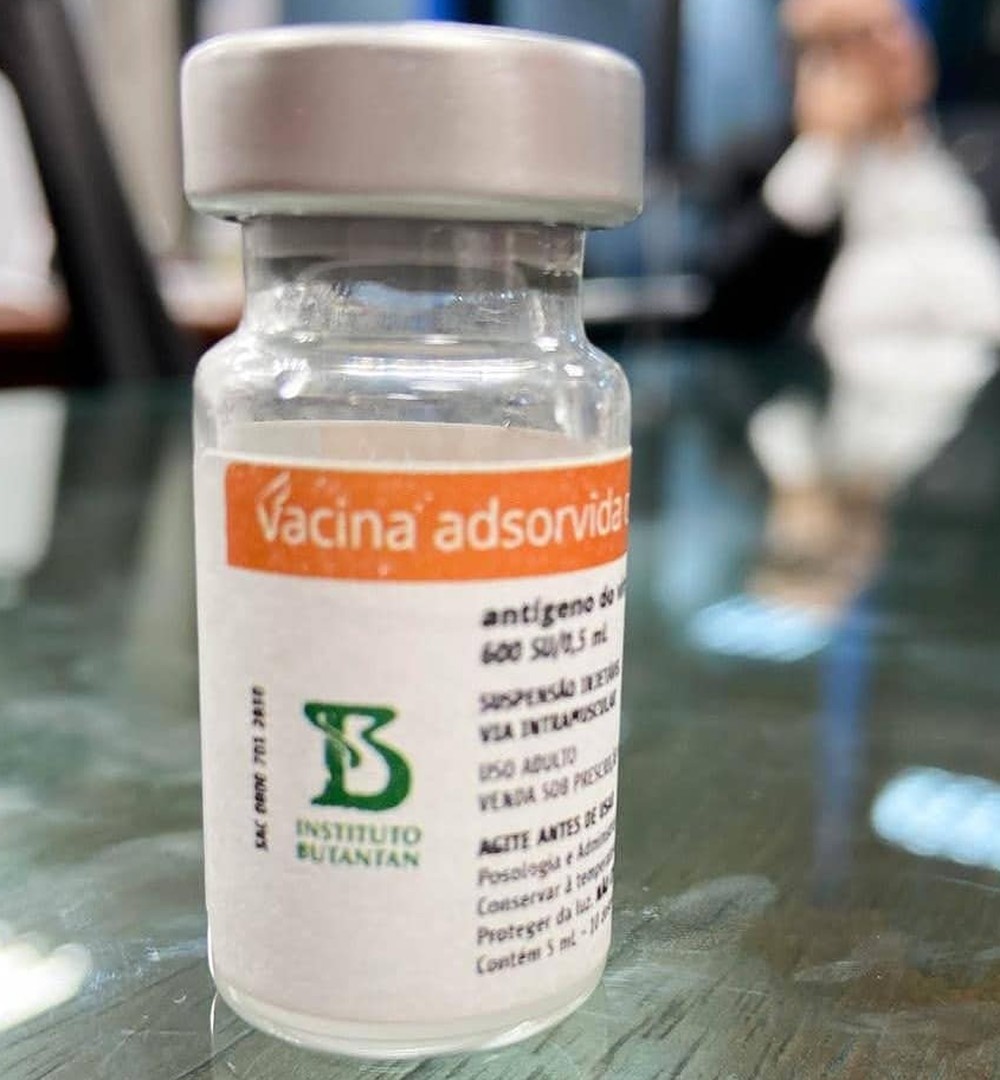 Butantan divulgou como será o frasco da vacina que pretende desenvolver em parecia com a chinesa Sinovac, que desenvolve a vacina — Foto: Divulgação
Butantan divulgou como será o frasco da vacina que pretende desenvolver em parecia com a chinesa Sinovac, que desenvolve a vacina — Foto: Divulgação
46 milhões de doses previstas
No total, o governo paulista fechou contrato com a Sinovac para a aquisição das 46 milhões de doses da CoronaVac. Essas primeiras 6 milhões virão prontas da China e as outras 40 milhões serão envasadas e rotuladas no Instituto Butantan a partir de material que será importado.
Mais cedo, também nesta sexta-feira, o diretor do Butantan, Dimas Covas, disse que o cronograma estipulado pelo governo de São Paulo para a produção da CoronaVac estaria mantido, independentemente de um suposto atraso da Anvisa em liberar a importação de matéria-prima da China.
No mesmo dia, a agência negou o entrave e liberou a compra das doses, mas a questão da importação da matéria-prima ainda não foi esclarecida.
“No momento o que nos importa é a matéria-prima, exatamente porque a fábrica, nossa linha de produção, está nesse momento parada aguardando a chegada dessa matéria-prima”, disse Dimas Covas, em entrevista ao Jornal Nacional nesta quinta-feira (23).
Mais centros de pesquisa
O governo de São Paulo também anunciou nesta sexta-feira (23) a criação de seis novos centros para a realização de testes da CoronaVac em voluntários. Com isso, o total de locais em que a pesquisa é realizada no país aumenta para 22.
A CoronaVac está na terceira fase de testes. O grupo de voluntários é formado exclusivamente por profissionais de saúde. Até agora, 15 mil vacinações foram aplicadas em nove mil voluntários. Cada voluntário recebe duas doses. Com a abertura dos novos centros, a meta é ampliar a pesquisa para o total de 13 mil voluntários.
Nessa fase final da pesquisa, metade dos participantes é inoculada com a vacina e a outra metade recebe placebo. Para determinar a eficácia da CoronaVac, é preciso que ao menos 61 participantes sejam contaminados pelo coronavírus.
Se o imunizante atingir os índices necessários de eficácia e segurança, poderá ser submetido à avaliação da Anvisa (Agência Nacional de Vigilância Sanitária) para registro e posterior uso na população.
Para agilizar o processo de análise de potenciais imunizantes contra o coronavírus, A Anvisa reduziu a exigência da documentação inicial e simplificou o processo de registro para que os dados dos estudos sejam enviados durante os trabalhos, e não somente ao final.
Até momento, apenas dados parciais referentes à segurança da vacina foram apresentados pelo governo de São Paulo, mas eles não foram enviados ao órgão ou publicados em revistas científicas.
Fonte: Meio Norte












